Un nouveau groupe d'une nouvelle classe d'antibiotiques glycopeptidiques dotés d'une approche unique pour attaquer les bactéries a été découvert, ce qui en fait un candidat clinique prometteur dans la lutte contre la résistance aux antimicrobiens.
Problématique de la résistance à l'antibiotique
Selon l'Organisation mondiale de la santé (OMS), la baisse des investissements privés et le manque d'innovation dans le développement de nouveaux antibiotiques sapent les efforts de lutte contre les infections résistantes aux médicaments.
Deux nouveaux rapports révèlent un faible pipeline d'agents antibiotiques. Les 60 produits en cours de développement (50 antibiotiques et 10 produits biologiques) apportent peu de bénéfices par rapport aux traitements existants et très peu ciblent les bactéries résistantes les plus critiques (bactéries Gram-négatives).
Si les candidats précliniques (ceux qui en sont aux premiers stades des essais) sont plus innovants, il faudra des années avant qu'ils n'atteignent les patients.
En 2017, l'OMS a publié la liste des agents pathogènes prioritaires, soit 12 classes de bactéries plus la tuberculose qui présentent un risque croissant pour la santé humaine car elles sont résistantes à la plupart des traitements existants, entre autre le SARM. La liste a été élaborée par un groupe d'experts indépendants dirigé par l'OMS afin d'encourager la communauté de la recherche médicale à mettre au point des traitements innovants pour ces bactéries résistantes.
Particularité des nouveaux glycopeptidiques
La corbomycine, récemment découverte, et la complestatine, moins connue, ont un moyen inédit de tuer les bactéries, qui consiste à bloquer la fonction de la paroi cellulaire bactérienne. La découverte provient d'une famille d'antibiotiques appelés glycopeptides qui sont produits par les bactéries du sol.
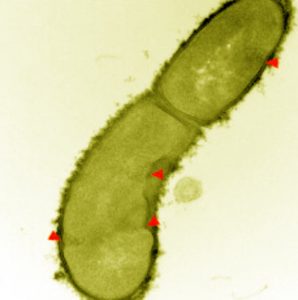
Les chercheurs ont également démontré chez la souris que ces nouveaux antibiotiques de la famille des glycopeptidiques peuvent bloquer les infections causées par un groupe de bactéries résistant aux médicaments, qui peut provoquer de nombreuses infections graves.
Les résultats ont été publiés il y a quelques jours, le 12 Février 2020, dans la revue Nature.
Les bactéries ont une paroi autour de l'extérieur de leurs cellules qui leur donne une forme et est une source de force
a déclaré la première auteur de l'étude, Beth Culp, candidate au doctorat en biochimie et sciences biomédicales à McMaster.

Les antibiotiques comme la pénicilline tuent les bactéries en empêchant la construction de la paroi, mais les antibiotiques que nous avons trouvés fonctionnent en fait en faisant le contraire - ils empêchent la paroi d'être brisée. C'est essentiel pour la division des cellules. Pour qu'une cellule se développe, elle doit se diviser et se développer. Si vous bloquez complètement la rupture du mur, c'est comme si elle était piégée dans une prison et qu'elle ne pouvait ni s'agrandir ni se développer.
En examinant l'arbre généalogique des membres connus des glycopeptides, les chercheurs ont étudié les gènes de ceux qui n'ont pas de mécanismes de résistance connus, avec l'idée qu'ils pourraient être un antibiotique démontrant une manière différente d'attaquer les bactéries.
Nous avons émis l'hypothèse que si les gènes qui fabriquent ces antibiotiques étaient différents, peut-être que la façon dont ils tuent les bactéries était également différente.
a déclaré M. Culp.
Approche de la découverte et mécanisme d'action
Le groupe a confirmé que la paroi bactérienne était le site d'action de ces nouveaux glycopeptidiques utilisant des techniques d'imagerie cellulaire en collaboration avec Yves Brun et son équipe de l'Université de Montréal.
Culp a déclaré :
Cette approche peut être appliquée à d'autres antibiotiques et nous aider à en découvrir de nouveaux avec des mécanismes d'action différents. Nous avons trouvé un tout nouvel antibiotique dans cette étude, mais depuis, nous en avons trouvé quelques autres de la même famille qui ont ce même nouveau mécanisme.
Les auteurs ont également démontré chez la souris que la corbomycine et la complestatine peuvent bloquer les infections causées par le Staphylococcus aureus résistant à la méthicilline (SARM).
L'équipe est dirigée par le professeur Gerry Wright du Centre David Braley pour la découverte d'antibiotiques au sein de l'Institut Michael G. DeGroote pour la recherche sur les maladies infectieuses à McMaster.
La recherche a été financée par les Instituts de recherche en santé du Canada et le Fonds de recherche de l'Ontario.
E.J. Culp et al. "Evolution-guided discovery of antibiotics that inhibit peptidoglycan remodelling", publié en ligne le 12 février 2020; doi: 10.1038/s41586-020-1990-9, Nature (2020). https://www.nature.com/articles/s41586-020-1990-9 DOI: 10.1038/s41586-020-1990-9